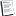
س1 : ماناتج تفاعل غاز النشادر مع كل من :
( حمض النيتريك - حمض الكبريتيك - حمض الفوسفوريك - حمض الهيدروكلوريك - الماء ).
حمض النيتريك مع غاز النشادر
NH3 + HNO3 = NH4NO3
ينتج نترات الامونيوم يستخدم كسماد ويحتوى على نيتروجين بنسبة 35% والزياده منه تسبب زياده حموضة التربة لانه ملح حامضى ناتج من حمض قوى وقاعدة ضعيفه وسريعة الذوبان فى الماء
غاز النشادر مع حمض الكبريتيك
NH3+ H2SO4 = (NH4)2SO4
ينشأ كبريتات الامونيوم ( سلفات النشادر ) يستخدم كسماد وايضا تعمل على زيادة حموضة التربة ولذلك يجب معادله التربه الى تستخدم فيها بصورة مستمرة
غاز النشادر مع حمض الفوسفوريك
NH3 + H3PO4 = (NH4)3PO4
ينتج فوسفات الامونيوم الذى يستخدم كسماد للتربه سريع الذوبان ويمدها بعنصرى الفوسفور والنيتروجين
غاز النشادر مع حمض الهيدروكلوريك
NH3 + HCL = NH4CL
تنتج سحب بيضاء من كلوريد الامونيوم عند تعريض ساق مبلله بحمض الهيدروكلوريك المركز لغاز النشادر
غاز النشادر مع الماء
NH3 + H2O = NH4OH
ينتج هيدروكسيد الامونيوم يزرق محلول دوار الشمس الاحمر اى انه قلوى التأثير
س2 : ما أثر الحرارة على كل من :
نترات البوتاسيوم - كربونات اللثيوم - حمض النيتريك - نترات البوتاسيوم وحمض الكبريتيك المركز - كلوريد الأمونيوم والجير المطفأ - هيدروكسيد النحاس
اثر الحرارة على نترات البوتاسيوم
2KNO3 = 2KNO2 + O2
يكون التفاعل مصاحب بانفجار شديد جدا لذا تستخدم نترات البوتاسيوم فى صناعة البارود ولكن لا تستخدم نترات الصوديوم ف صناعة البارود لانها مادة متيمعه لها القدرة على امتصاص بخار الماء
اثر الحرارة على كربونات اللثيوم
Li2CO3 = Li2O + CO2
تنحل كربونات الليثيوم بالحرارة الى اكسيد ليثيوم ويتصاعد غاز ثانى اكسيد الكربون الذى يعكر ماء الجير الرائق عند درجه حرارة 1000درجه سليزيوس
اثر الحرارة على حمض النيتريك
HNO3 = HNO2 +O2
4HNO2 = 4NO2 + 2H2O
اثر الحرارة على نترات البوتاسيوم وحمض الكبريتيك المركز
2KNO3 + H2SO4 = K2SO4 +2HNO3
يحدث احلال مزدوج بين الشقوق الايونية
اثر الحرارة على كلوريد الامونيوم والجير المطفا
2NH4Cl + Ca(OH)2 = 2NH3 + CaCl2 + 2H2O
ينتج غاز النشادر الذى يجمع بازاحه الهواء لاسفل ( طريقة تحضير النشادر فى المعمل )
اثر الحرارة على هيدروكسيد النحاس
Cu(OH)2 = CuO + H2O
يتصاعد بخار الماء وينتج راسب من اكسيد النحاس الاسود
|