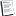
كما أن قدرة حمض الكبريتيك على إزالة الماء جعلته يستخدم في تفاعلات الاسترة والنيترة لإزالة الماء الناتج في هذه التفاعلات وبذلك يمنع انعكاس التفاعل .
C2H5OH + CH3COOH = CH3COOC2H5 + H2O
الخواص الحمضية لحمض الكبريتيك
يتأين حمض الكبريتيك في المحلول المائي مكوناً أيونات الهيدروجين .
H2SO4 ===> 2H(+) + SO4(2-) x
يتفاعل حمض الكبريتيك مع القواعد والقلويات مكوناً الكبريتات العادية أو الكبريتات الحمضية .
H2SO4 +2NaOH ------> Na2SO4 + 2H2O
H2SO4 + NaOH ------> NaHSO4 + H2O
ونظراً لارتفاع درجة غليان حمض الكبريت بالنسبة للأحماض العادية الأخرى فإنه أقل تطايراً منها ولذا يتفاعل الحمض المركز مع أملاح هذه الأحماض ويزيح أحماضها .
فيتفاعل مثلاً مع الكلوريدات مكوناً كلوريد الهيدروجين .
H2SO4 +2NaCl = Na2SO4 + 2HCl
و مع النترات مكوناً حمض النيتريك .
H2SO4 +2NaNO3 = Na2SO4 + 2HNO3
كما يمكن أن يتفاعل مع كلاً من CaF2 و NaI
H2SO4 + CaF2 -------> 2 HF + CaSO4
H2SO4 + 2 NaI --------> 2 HI + Na2SO4
حمض الكبريتيك كعامل مؤكسد
لحمض الكبريت المركز الساخن خواص مؤكسدة بالإضافة الى خواصه الحمضية فيتفاعل مع كثير من الفلزات حيث يختزل الى ثاني أكسيد الكبريت كما في حالة النحاس مثلاً .
Cu + 2 H2SO4 ==> CuSO4 + SO2 + 2 H2O
ويتفاعل الحمض المركز مع الخارصين وينتج بالإضافة الى ثاني أكسيد الكبريت بعض كبريتيد الهيدروجين والكبريت .
ويؤكسد الحمض أيضاً كثيراً من اللا فلزات كالكربون والكبريت .
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
S + 2H2SO4 = 3SO2 + 2H2O
تفاعل حمض الكبريتيك مع المركبات العضوية العطرية
يتفاعل حمض الكبريتيك المركز مع الكثير من المركبات العضوية العطرية حيث تستبدل ذرة من ذرات الهيدروجين بها بمجموعة حمض السلفونيك , ولهذا التفاعل أهمية كبيرة في تحضير الكثير من المركبات كا لفينول والسكارين , فيتفاعل مثلاً مع البنزين مكوناً حمض البنزين سلفونيك .
C6H6 + HO.SO2.OH = (C6H5.SO2.OH) + H2O
استخدامات حمض الكبريتيك
لحمض الكبريتيك استخدامات عديدة فهو يدخل بشكل ما في معظم المواد المصنوعة تقريباً ويعتبر مستوى انتاجه دليلاً على القدرة الصناعية لأي بلد وتعود وفرة استخدامه الى رخصه وتنوع تأثيره الكيميائي .
يدخل حمض الكبريتيك في انتاج الأصباغ والكحولات والبلاستيك والمطاط وصناعة الصابون والمنظفات والمفرقعات وحفظ بعض الأطعمة وفي صناعة الورق و صناعة الحديد والنحاس و سحب الألمنيوم , كما يدخل في منتجات صيدلية ونفطية عديدة .
ولعل أهم استخداماته تتمثل بصفة أساس فيما يلي :
1- كمادة مؤكسدة ونازعة للماء .
لذا يستخدم حمض الكبريت في تجفيف المركبات الكيميائية من الماء .
2- إنتاج الأسمدة الكيميائية مثل :
أ- سماد سوبر الفوسفات الأحادية .
وذلك بتفاعل حمض الكبريتيك مع الصخور الفوسفاتية كما يلي :
x2H2SO4 + Ca3(PO4)2 --------> CaSO4 + Ca(H2PO4)2
ب- سماد كبريتات الأمونيوم .
ويحضر بتفاعل حمض الكبريت مع الأمونيا على النحو التالي :
H2SO4 + 2NH3 -------> (NH4)2SO4
3- تحضير الكبريتات .
مثل كبريتات الصوديوم ( تستخدم في صناعة الورق والمنظفات والزجاج وتحلية المياه) , وكبريتات الألومنيوم ( صناعة الزيوت وتكرير النفط) , وكبريتات البوتاسيوم ( صناعة الأسمدة والزجاج والشبة والمواد الغذائية ) .
مثال يوضح كيفية تحضير كبريتات الصوديوم بواسطة حمض الكبريتيك :
H2SO4 + NaCl -------> NaHSO4 + HCl
NaHSO4 + NaCl -------> Na2SO4 + HCl
4- صناعة بطاريات السيارات .
ويسمى حمض الكبريت في هذه الحالة بماء النار أو الأسيد (Acid) , ويصل تركيزه في البطارية الى 33.33 % حامض كبريتيك
__________________
اطلبوا العلم، فإن عجزتم فأحبوا أهله، فإن لم تحبوهم فلاتبغضوهم هيا بنا نتعلم الديمقراطية <!-- Facebook Badge START --><!-- Facebook Badge END -->
|