
07-12-2010, 09:15 PM
|
 |
مستشار مادة الكيمياء
|
|
تاريخ التسجيل: Apr 2008
المشاركات: 2,843
معدل تقييم المستوى: 20
|
|
اقتباس:
المشاركة الأصلية كتبت بواسطة شادى سلام
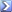
عينة غير نقية من كربونات كالسيومcaco3 كتلتها 5 جرام اضيف اليها 100مل من حمض الهيدروكلوريك تركيزة 1مولر وبمعادلة الفائض من الحمض بعد تمام التفاعل لزم 60 مل من هيدروكسيد الصوديوم 1و مولر احسب النسبة المؤية للشوائب
|
عدد مولات الحمض الزائد = عدد مولات الصودا الكاوية المتعادل = 0.06 × 0.1 = 0.006 مول
عدد مولات الحمض المضاف للعينة = 0.10 × 1 = 0.10 مول
عدد مولات الحمض المتفاعل مع كربونات الكالسيوم = 0.10 – 0.006 = 0.094 مول
2HCl -------- CaCO3
2 ---------------100
0.094 ------------------ X
كتلة كربونات الكالسيوم في العينة = (100 × 0.094) ÷ 2 = 7و4 جرام
نسبة كربونات الكالسيوم في العينة =(7و4× 100)÷5 = 94%
وبالتالى تكون نسبة الشوائب فى العينة 6%
بالتوفيق
__________________
 مستر// فيكتور بخيت مستر// فيكتور بخيت
استاذ الكيمياء
|