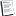
علل :- القنطرة الملحية تمنع تكوين فرق الجهد ؟
وفى الخلية الجلفانية فى بداية الأمرينشأ فرق فى الجهد بين ساق المعدن( الفلز) المستخدم وأيوناته فى المحلول الموضوع فيه .
فينشأ مثلا" فرق جهد بين قطب الخارصين ومحلول كبريتات الخارصين حيث يذوب من الخارصين أكثر مما يترسب عليه أى تفاعل أكسدة ذرات الخارصين اكثر من تفاعل إختزال أيونات الخارصين وبالتالى يتبقى على لوح الخارصين إلكترونات سالبة ( أصبح قطب غنى بالإلكترونات )
.وفى نصف خلية النحاس نجد أن قطب النحاس عندما يوضع فى محلول لأيوناته . يترسب عليه اكثر مما يذوب فيه.أى يحدث تفاعل إختزال على لوح النحاس أى يصبح لوح النحاس مفتقد للإلكترونات أى يصبح قطب موجب ويكون تفاعل أكسدة ذرات النحاس أقل من تفاعل إختزال أيوناته الموجود فى المحلول الموضوع فيه.
فينشأ فرق فى الجهد بين اللوحين لوح الخارصين ولوح النحاس يؤدى لمرور التيار الكهربى من الخارصين إلى النحاس عند إتصالهما معاً لتكوين خلايا جلفانية
أى أن :- الخارصين تتراكم عليه الألكترونات الناتجه من كثرة ذراته المتأكسدة حيث أنه كما نعلم تنتج ألكترونات من عملية الأكسدة
والنحاس اصبح مفتقر للألكترونات بسبب كثرة عملية الإختزال وهذا يصنع فرق جهد يؤدى إلى مرور تيار كهربى بين طرفى الخليه أى بين اللوحين عند إتصالهما معا" لتكوين خلية جلفانية
لكن مع مرور الوقت تزداد الشحنة الموجبة فى محلول الخارصين (أيونات الخارصين الموجبة ) وتزداد
الشحنة السالبة فى محلول النحاس (أيونات الكبريتات السالبة لو كان المحلول لكبريتات النحاس )
وهذا بالطبع يصنع فرق جهد بين المحلولين يعاكس فرق الجهد بين اللوحين لأن محلول النحاس سالب ومحلول الخارصين موجب بينما لوح الخارصين سالب ولوح النحاس موجب .
وإذا ترك هذا الفرق فى الجهد ينمو مع مرور الوقت فسوف يساوى الناشئ من اللوحين وعندئذا" يتوقف التيار الكهربى
ولذلك كان إستخدام القنطرة الملحية لغرض منع تكون فرق جهد بين المحلولين فى نصفى الخلية "
س2:- ماهو القطب الخامل؟
القطب الخامل :-
هو القطب الذى لا يشترك فى التفاعلات التى تتم فى الخلية الكهربية كأقطاب البلاتين والجرافيت
دور القنطرة الملحية :-
عبارة عن أنبوبة مسامية ذات شعبتين بها محلول الكتروليتى مثل كبريتات الصوديوم
لاتتفاعل ايوناتها مع ايونات محاليل نصفى الخلية ولا مع مواد أقطاب الخلية
تقوم بالتوصيل بين محلولي نصفى الخلية
تمنع الاتصال المباشر بين محلولي نصفى الخلية
تمنع تكوين فرق جهد بين محلولي نصفى الخلية
تقوم بمعادلة الشحنات الكهربية الموجبة والسالبة التي تتكون فى محلولي نصفى الخلية نتيجة الأكسدة والاختزال وبالتالي تعمل على الوصول إلى حالة التعادل الكهربي لمحلولي نصفى الخلية وعدم تشبع اى منهما بأيونات موجبة أو سالبة زائدة وبذلك يستمر سريان التيار
غياب القنطرة الملحية يؤدى إلى توقف تفاعل الأكسدة والاختزال التلقائي وبالتالي يتوقف مرور التيار الكهربي فى السلك الخارجي .
الرمز الاصطلاحي للخلية Zn │ Zn+2 ║ CU+2│ CU
XM XM
|