
07-01-2014, 01:59 AM
|
 |
مستشار مادة الكيمياء
|
|
تاريخ التسجيل: Apr 2008
المشاركات: 2,843
معدل تقييم المستوى: 20
|
|
اقتباس:
المشاركة الأصلية كتبت بواسطة كامل خميس
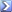
أرجو من الاساتذة حل هذه المسألة
اذا فرض أن حمض الهيدروكلوريك المركز يحتوى على40%من كتلة كلوريد الهيدروجين وكثافته 1,2 جم/مل فما كتلة الصودا الكاوية اللازمة للتفاعل تماما مع 146مل من الحمض؟وما كتلة الملح الناتج؟
|
كتلة الحمص النقى فى اللتر= كثافة الحمض ×1000 × النسبة المئوية =1.2 ×1000 ×0.40 = 480 جرام
مولارية الحمض= 480÷36.5 = 13.15 مولر ( لانه عندما يكون الحجم واحد لتر يكون المول هو المولر)
نكتب معادلة تعادل الصودا الكاوية مع حمض الهيدروكلوريك هيكون
عدد مولات الحمض = عدد مولات القلوى = 1 مول لكل منهما
عدد المولات= الحجم × التركيز
حجم الحمض × تركيزه = حجم القلوى × تركيزه
0.146 × 13.15 = عدد مولات القوى
عدد مولات القلوى = 1.19199 مول
كتلة القلوى = 1.9199 × 40 = 76.796 جرام
من المعادلة الموزونة كل 40 جرام صودا كاوية تعطى 58.5 جرام من ملح كلوريد الصوديوم
اذا 76.796 جرام من الصودا الكاوية تعطى س جرام من الملح
وسطين فى طرفين
كتلة الملح الناتج = ( 58.5 × 76.796) ÷40 = 112.314 جرام
بالتوفيق
__________________
 مستر// فيكتور بخيت مستر// فيكتور بخيت
استاذ الكيمياء
|