
27-12-2008, 08:23 AM
|
|
مدرس كيمياء
|
|
تاريخ التسجيل: Dec 2006
المشاركات: 2,359
معدل تقييم المستوى: 0
|
|
اقتباس:
المشاركة الأصلية كتبت بواسطة mony1994
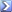
المركب الذى يحتوى على 37%نيتروجين ,63%اكسجين,تكون صيغته الاولية ؟
علل:
الكتلة الفعليةلذرة الهيدروجين العادى تساوى تقريبا كتلته الحسابية.
|
عدد مولات النيتروجين=37 ÷ 14 = 2.64 مول
عدد مولات الأكسيجين= 63 ÷16 =4 3.9 مول
أبسط نسب بالقسمة على أقل عدد مولات
نيتروجين=2.64 ÷ 2.64 = 1 مول
أكسيجين= 3.94 ÷ 2.64 =1.5 مول
بالضرب ×2 لجعل عدد المولات أعداد صحيحة
عدد مولات النيتروجين = 1×2 = 2 مول
عدد مولات الأكسيجين = 1.5 ×2 = 3 مول
الصيغة الأولية n2o3
الكتلة الفعلية للهيدروجين العادي تساوي الكتلة الفعلية لأن نواته تحتوي على بروتون واحد ولا تحتوي على نيوترونات وبالتالي لا توجد طاقة ترابط نووي أي لا يوجد نقص في الكتلة
|