|
||||||
| أرشيف المنتدي هنا نقل الموضوعات المكررة والروابط التى لا تعمل |
|
|
أدوات الموضوع | ابحث في الموضوع | انواع عرض الموضوع |
|
#1
|
||||
|
||||
|
ير القطبية الكيميائية عادةً إلى فصل الشحنات الكهربائية جزئيا في الجزيئ مؤدية إلى أكتسابه لعزم ثنائي القطب أو عزم متعدد القطبية. تترابط الجزئيئات القطبية من خلال قوى بين جزيئية قطبية والرابطة الهيدروجينية. تعتمد القطبية الجزيئة على اختلاف السالبية الكهربائية للذرات المختلفة المكونة للجزيئ. فعلى سبيل المثال يعتبر الماء مركب قطبي بسبب عدم التوازن في التوزيع الإلكتروني في ترابط الهيدروجين مع الأكسجين ، بينما يعتبر الميثان مركب غير قطبي بسبب التوازن في التقاسم الإلكتروني بين الكربون والهيدروجين. تؤثر القطبية الكهربائية على العديد من الخصائص مثل التوتر السطحي والانحلالية إضافة إلى نقطتي الغليان والانصهار.
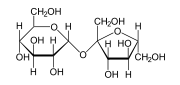
 تنتج عن نظرية القطبية الكيميائية ظواهر عديدة، فهي تفسر مثلا سبب قدرة بعض الحشرات أن تطفو على سطح الماء، وتفسر سبب تجمد المسطحات المائية من السطح ثم إلى الأسفل. فقطبية جزيئات الماء تجعل لها خواص ذات أهمية. يمكن وصف جزيئات بأنها ذات "روابط قطبية" أو "روابط لاقطبية" .إلا أن هذا التعتيم هو أمر نسبي في كثير من الأحيان، فيمكن لجزيء واحد أن يكون ببساطة أكثر قطبية من جزيء آخر. ومع ذلك ، فإن الخصائص التالية هي نموذجية لمثل هذه الجزيئات. الجزيئات القطبية من الأمثلة الشائعة على الجزيئات القطبية المنزلية مركب السكر ، يتنوع سكروز السكر. ويحوي السكروز على العديد من الروابط القطبية بين الاوكسجين والهيدروجين (- OH) . ونظرا لطبيعة القطبية للجزيء الماء (H2O) نفسه، فالجزيئات القطبية عادة تستطيع الذوبان في الماء.
 يبين المخطط التأثير الشبكي للتوزيع المتناظر للروابط القطبية ويبين السهم الأصفر اتجاه تحرك الإلكترونات وهذا الترتيب الشكبي يؤدي إلى زيادة الشحنة السالبة مع زيادة الشحنة الموجبة. يبين المخطط التأثير الشبكي للتوزيع المتناظر للروابط القطبية ويبين السهم الأصفر اتجاه تحرك الإلكترونات وهذا الترتيب الشكبي يؤدي إلى زيادة الشحنة السالبة مع زيادة الشحنة الموجبة.قد يكون جزيء ما غير قطبي لوجود راوبط لا قطبية (عندما يكون هناك تقاسم متساو للإلكترونات بين الذرات أو بسبب الترتيب المتناظر للروابط القطبية(كل رابطتيين تفنيان بعضهما البعض) من الأمثلة على المركبات الغير قطبية المنزلية الدهون والزيوت والبنزين. ولذلك معطم الجزيئات الغير قطبية هي مركبات غير قابلة للذوبان في الماء عند درجة حرارة الغرفة. لكن العديد من المذيبات العضوية غير القطبية، مثل التربنتين، قادرين على حل المواد القطبية. عند المقارنة بين جزيء قطبي وغير قطبي لهما نفس الكتلة المولية، يكون للجزيء القطبي عموما نقطة الغليان أعلى ، بسبب التفاعل بين ثنائي القطب،. الشكل الأكثر شيوعا من هذا النوع من التفاعل هو الرابطة الهيدروجينية .
هي عبارة عن جزيئات كبيرة لها نهاية واحدة برابطة قطبية ترتبط مع مجموعة أخرى لها نهاية أخرى غير قطبية وهي مؤثر سطحي جيد. يمكن أن تساعد هذه المركبات في تشكيل المستحلبات المستقرة ، أو مزيج من الماء والدهون. كما تؤدي إلى خفض التوتر السطحي بين الزيت والماء بواسطة الامتزاز في السطح التماسي للسائل-سائل.
|
| العلامات المرجعية |
| الكلمات الدلالية (Tags) |
| المال, قطبية |
«
الموضوع السابق
|
الموضوع التالي
»
|
|
جميع الأوقات بتوقيت GMT +2. الساعة الآن 09:33 AM.
Powered by vBulletin® Version 3.8.11
Copyright ©2000 - 2024, Jelsoft Enterprises Ltd.
Copyright ©2000 - 2024, Jelsoft Enterprises Ltd.



















 العرض العادي
العرض العادي

