|
||||||
| كليات المجموعة العلمية (الطب البشري - طب الأسنان - الطب البيطري - العلوم الطبية التطبيقية - العلاج الطبيعي - الصيدلة - التمريض - العلوم - الزراعة) |
 |
|
|
أدوات الموضوع | انواع عرض الموضوع |
|
#1
|
||||
|
||||
|
Molarity, Molality and Normality
The quantitative relationship between chemical substances in a reaction is known as stoichiometry. Avogadro was a pioneer in this field of chemistry. Avogadro hypothesized that there was a specific number that would represent the number of atoms or molecules in a mole of that atom or molecule. The weight of that unit known as a mole would be *****alent to the atomic or molecular weight of the atom or molecule in grams. According to this theory, one mole of carbon-12 would have a mass of 12 grams because carbon-12 has an atomic weight of 12 (6 neutrons and 6 protons). One mole of hydrogen would weigh one gram and would contain the same number of atoms as one mole of carbon. The magical number was, in fact, discovered to be 6.024E23. It was named the Avogadro Number in honor of the father of stoichiometry even though he did not actually determine the exact number. The modern definition of a mole is as follows:
Exactly one mole represents the number of carbon atoms in exactly 12 grams of the carbon-12 isotope. For an atom a mole represents 6.02E23 atoms. For a molecular compound, one mole represents 6.02E23 molecules. One could even take it to extremes and say that one mole of bananas is equal to 6.02E23 bananas. Now you might ask, "what relevance does the Avogadro number have for me?" The answer is, just about everything when you are working in a chemistry lab. On the other hand, it is totally useless as a unit of measure for bananas. One atom or even ten atoms are too small for an individual to measure out in a lab. A mole of a substance equals the gram-formula mass or the gram-molar mass. This equals the sum of all of the masses of all the elements in the formula of the substance. Basically, if one were to count all of the carbon atoms in one one mole of carbon-12, there would be 6.02E23 atoms and it would weigh 12 grams (remember the atomic weight of carbon is 12). Using the information above, it is possible to calculate concentrations of solutions and make up solutions of desired concentration. It is also possible to use this information to determine how much of a given base would be needed in order to neutralize a specific acid and reach a pH of 7. There are five units of concentration that are particularly useful to chemists. The first three: molality, molarity and normality are dependant upon the mole unit. The last two: percent by volume and percent by weight have nothing to do with mole, only weight or volume of the solute or substance to be diluted, versus the weight or volume of the solvent or substance in which the solute is diluted. Percentages can also be determined for solids within solids. Molality: The molal unit is not used nearly as frequently as the molar unit. A molality is the number of moles of solute dissolved in one kilogram of solvent. Be careful not to confuse molality and molarity. Molality is represented by a small "m," whereas molarity is represented by an upper case "M." Note that the solvent must be weighed unless it is water. One liter of water has a specific gravity of 1.0 and weighs one kilogram; so one can measure out one liter of water and add the solute to it. Most other solvents have a specific gravity greater than or less than one. Therefore, one liter of anything other than water is not likely to occupy a liter of space. To make a one molal aqueous (water) solution of sodium chloride (NaCl) , measure out one kilogram of water and add one mole of the solute, NaCl to it. The atomic weight of sodium is 23 and the atomic weight of chlorine is 35. Therefore the formula weight for NaCl is 58, and 58 grams of NaCl dissolved in 1kg water would result in a 1 molal solution of NaCl. Molarity: The molar unit is probably the most commonly used chemical unit of measurement. Molarity is the number of moles of a solute dissolved in a liter of solution. A molar solution of sodium chloride is made by placing 1 mole of a solute into a 1-liter volumetric flask. (Taking data from the example above we will use 58 grams of sodium chloride). Water is then added to the volumetric flask up to the one liter line. The result is a one molar solution of sodium chloride. Normality: There is a relationship between normality and molarity. Normality can only be calculated when we deal with reactions, because normality is a function of *****alents. The example below uses potassium hydroxide (KOH) to neutralize arsenic acid. By studying the reaction it is possible to determine the proton exchange number to determine the normality of the arsenic acid. Look at the equation H3AsO4 + 2KOH --> K2HAsO4 + 2H2O: *****alent weight = molar mass/(H+ per mole) *****alent = mass of compound / *****alent weight And Normality = (*****alents of X)/Liter And the part that is of interest to you is that Normality = molarity x n (where n = the number of protons exchanged in a reaction). You probably remember that when a hydrogen atom is ionized and loses its electron, you are left with only a proton. So a hydrogen ion is basically a proton. Let's assume that we have a 0.25 M solution of H3AsO4 and want to determine the normality of it if it participates in the reaction H3AsO4 + 2KOH --> K2HAsO4 + 2H2O When H3AsO4 is neutralized by KOH, H3AsO4 provides two protons to form 2H2O. Note that H3AsO4 has three hydrogens, but K2HAsO4 only has one hydrogen. That means that 2 protons were exchanged, Again normality = molarity * n Remember that normality of the solution is 0.25 mol H3AsO4 and there were two protons exchanged (2 *****alents/mole) 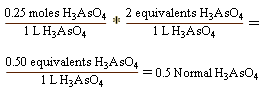 So, in short, while there is a relationship between the normality of a solution and the molarity of a solution, the normality can only be determined by examining reaction, determining the proton exchange and multiplying molarity by that number. Normality is particularly useful in titrations calculations. Where N = normality, V = volume, a = the substance on the left of the equation involved in proton exchange, and b=substance on the right of the equation involved in proton exchange: NaVa = NbVb Percentages are easy to calculate because they do not require information about the chemical nature of the substance. Percentages can be determined as percent by weight or percent by volume. Percent by weight: To make up a solution based on percentage by weight, one would simply determine what percentage was desired (for example, a 20% by weight aqueous solution of sodium chloride) and the total quantity to be prepared. If the total quantity needed is 1 kg, then it would simply be a matter of calculating 20% of 1 kg which, of course is: 0.20 NaCl * 1000 g/kg = 200 g NaCl/kg. In order to bring the total quantity to 1 kg, it would be necessary to add 800g water. Percent by volume: Solutions based on percent by volume are calculated the same as for percent by weight, except that calculations are based on volume. Thus one would simply determine what percentage was desired (for example, a 20% by volume aqueous solution of sodium chloride) and the total quantity to be prepared. If the total quantity needed is 1 liter, then it would simply be a matter of calculating 20% of 1 liter which, of course is: 0.20 NaCl * 1000 ml/l = 200 ml NaCl/l. Percentages are used more in the technological fields of chemistry (such as environmental technologies) than they are in pure chemistry.
__________________
 دكتور عاطف خليفة كيميائي 500 امتحان كيمياء |
|
#2
|
||||
|
||||
|
النورمالتي هي العياريه قانونها الاتي
ك الماده المذابه بالجرام = الكتله المكافئه × العياريه نورمالتي × الحجم باللتر الكتله المكافئه = الكتله الجزيئيه ÷ التكافؤ وان شاء فيه محاضرات عربي ساضعها
__________________
 دكتور عاطف خليفة كيميائي 500 امتحان كيمياء |
|
#3
|
||||
|
||||
|
بسم الله الرحمن الرحيم
فى الاعمال التحليليةالطرق الاتية هى الاكثر استعمالا للتعبير عن التركيز: 1)النسبة الوزنية : percentage of weight وفيها يعبر عن التركيز بعدد الجرامات للمذاب لكل 100جراممن المحلول او المذيب 2)عدد الجرامات لكل وحدة حجوم : Grams per unit volume وفيها يعبر عن التركيز بعدد الجرامات للمذيب لكل واحد لتر من المحلولاوالمذيب 3)المولاليية : Molality وتعرف على انها عدد الجرامات المولية gram-moles من المذاب الذائبة فى 1000جرام من المحلول او المذيب اى ان 1 مولالمن هيدروكسيد الصوديوم هو 40جرام من هيدروكسيد الصوديوم مذابة فى 1000 جرام منالمذيب 4)المولارية :Molarity وتعرف على انها عدد الجرامات المولية منالمذاب الذائبة فى واحد لتر من المحلول او المذيب اى ان 1 مولار من HCl هو 36.5جرام من حمض الهيدروكلوريك مذابة فى واحد لتر من المذيب 5)العيارية : Normality وتعرف على انها عدد الجرامات المكافئة Gram-*****alent من المذابالمذابة فى واحد لتر من المحلول او المذيباى ان 1 عيارى من كربونات الصوديومهو 53جرام منها مذابة فى واحد لتر من المذيب 6)الجزء المولى : Mole fraction نفرض ان محلول من مكونان A ,B فأن الجزء المولى للمكون Aهو عددالمولات للمكونA مقسوما على حاصل جمع كل من عدد مولات AوعددمولاتB X(A)=nA/(nA+n  .........1 .........1X(  =nB/(nA+n =nB/(nA+n .........2 .........2X(A)+X(  =1...................3 =1...................3الوزن المكافىء :The *****alent weight تتغير قيمة الوزنالمكافىء تبعا لنوع التفاعل(تفاعل تعادل او اكسدة واختزال او تراكبcomplex) بلان المادة الواحدة لديها اوزان مكافئة مختلفة تبعا لنوع التفاعل اولا: حساب الوزن المكافىء فى تفاعلات التعادل:Neutralisation reactions أ) الوزنالمكافىء للحمض يساوى الوزن الجزيئى للحمض مقسوما على عدد ذرات الهيدروجينالمستبدلة للحمض فى تفاعل التعادل HCl..........>H+ +Cl- 0 اذن الوزنالمكافىء لحمض الهيدروكلوريك هو 36.5/1=36.5جرام مكافىء H3PO4............> 3H+ +PO4- 0 اذن الوزن المكافىء لحمض الفسفوريك هو 97/3=32.33جراممكافىء ب )ايضا الوزن المكافىء للقاعدةBASE يساوى الوزن الجزيئى للقاعدةمقسوما على عدد مجموعات الهيدروكسيل المستبدلة فى تفاعل التعادل NaOH ...............>Na+ +OH- 0 اذن الوزن المكافىء لهيدروكسيد الصوديوم هو 40/1=40جرام مكافىء Al(OH)3................>Al+ +3OH- 0 اذن الوزنالمكافىء لهيدروكسيد الالومنيوم هو 78/3=26جرام مكافىء ج)اما الوزن المكافىءللملح فيساوى الوزن الجزيئى للملح مقسوما على حاصل ضرب عدد الكاتيونات(الشقوقالموجبة)فى تكافؤ الكاتيون فمثلا الوزن المكافىء لكربونات الصوديوم يحسبكالاتى Na2CO3..................> 2Na+ +CO3-- 0 الوزن الجزيئى لكربوناتالصوديوم يساوى 2*23+12+3*16=106 اذن الوزن المكافىء =106/(2*1)=53جراممكافىء ثانيا:حساب الوزن المكافىء فى تفاعلات الاكسدة_اختزال Oxidation-reduction reactions يحسب الوزن المكافىء للعامل المؤكسدoxidizing agent او العامل المختزلreducing agent بان تقسم الوزن الجزيئى للمادة على التغيرالكلى فى عدد التاكسد للعناصرالمتاكسدة او عدد الالكترونات المنتقلة خلال نصفالتفاعلالمثال Cr2o7-- +6Fe++ +14H+ ...........>2Cr+++ +6Fe+++ +7H2O فى هذا التفاعل تغير عدد التاكسد لذرتى الكروم من +12 الى +6 لذا الوزنالمكافىء لمادة ثانى كرومات البوتاسيومK2Cr2O7يساوى وزنها الجزيئى مقسوما على 6 وعموما الوزن المكافىء فى تفاعل الاكسدة اختزال يساوى الوزن الجزيئةللمادة مقسوما علة حاصل ضرب التغير فى تكافىءكاتيون معين فى عدد هذا الكاتيون
__________________
 دكتور عاطف خليفة كيميائي 500 امتحان كيمياء |
|
#4
|
||||
|
||||
|
و الله يا دكتور عاطف بجد مش عارفة اشكر حضرتك ازاى
ربنا يكرم حضرتك ياااااااااارب و يجعله فى ميزان حسناتك |
 |
| العلامات المرجعية |
«
الموضوع السابق
|
الموضوع التالي
»
|
|
جميع الأوقات بتوقيت GMT +2. الساعة الآن 02:29 PM.








 العرض العادي
العرض العادي

